AG Tumorimaging
& Immunologie
Unsere Arbeitsgruppe befasst sich mit den drei Schwerpunkten:
- Tumor Imaging
- Radioonkologie
- Biomarker und Tumor Immunologie
Tumor Imaging
Eine effektive Visualisierung von Tumoren ist die Grundlage für eine frühzeitige Diagnose ebenso wie für ein effektives Therapie-Monitoring. Um die Sensitivität und Präzision der dafür notwendigen Bildgebung zu erhöhen, werden verstärkt Techniken eingesetzt, die auf der selektiven Markierung von Tumorzellen im Primärtumor und aller vorhandenen Metastasen basieren. Besonders bei der gezielten Bekämpfung der Läsionen mittels chirurgischer Sektion oder Radiotherapie ist eine Erfassung aller vorhandenen Tumore unablässig.
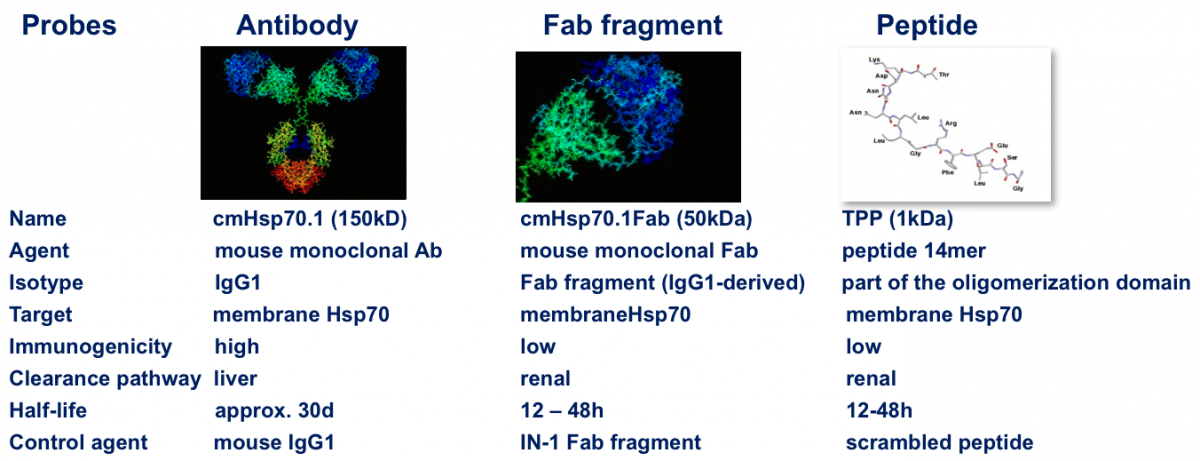
Unser Labor entwickelt und untersucht hierfür selektive Tumorwerkzeuge (Antikörper, Fab Fragment, Peptide), die nach intravenöser Gabe oder topischer Applikation alle Tumorherde im Körper selbständig detektieren. Grundlage dafür ist die besondere Eigenschaft von Tumoren fast aller Entitäten, den Tumorbiomarker Hitzeschockprotein 70 (Hsp70), ein Protein der Klasse der molekularen Chaperone, auf der Oberfläche von maligne entarteten Zellen zu präsentieren. Dieser tumor-spezifische Biomarker kann je nach Anforderung mit Signalmolekülen oder Zell-Therapeutika wie z.B. CAR T/NK-Zellen ausgestattet werden, um den Tumor sichtbar zu machen und/oder auch direkt zu bekämpfen (Theranostik). Ein neuartiger ELISA (Hsp70 exo ELISA) ist in der Lage Hsp70, das von Membran Hsp70 positiven Tumoren stammt im Blut zu detektieren und kann somit als companion Diagnostic zur Patientenrekrutierung eingesetzt werden.
Förderung
- SFB824
Schlüsselpublikationen
- Stangl et al. PNAS 108:733, 2011
- Stangl et al. Can Res 74:6903, 2014
- Stangl et al. Can Res 78:6269, 2018
- Fang et al. EJNMMI 49:2049-2063, 2022
- Bashiri et al. Front Immunol 13:883694, 2022
- Holzmann et al. Br J Can 131:1814-1824, 2024
Radioonkologie
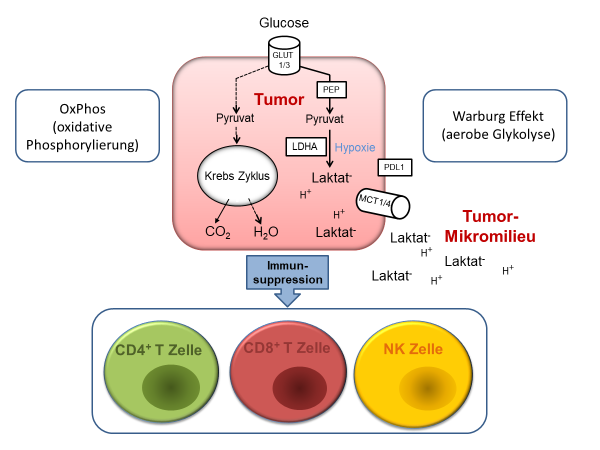
Aufgrund der gesteigerten Proliferationsraten in Tumorzellen kommt es zu einer metabolischen Umprogrammierung zugunsten der aeroben Glycolyse (Warburg Effekt). Der Warburg-Effekt erlaubt eine rasche ATP Produktion, die mit einem Anstieg von Oncometaboliten wie z. B. Laktat in Tumormikromilieu assoziiert ist. Hohe Laktat-Gehalte erlauben Tumor-Immun-Escape-Mechanismen und fördern Immunsuppression. Eine chaotische Gefäßversorgung im Tumor führt zur Hypoxie.
Förderung
- Kompetenzverbund Strahlenforschung
Schlüsselpublikationen
-
Fellinger et al. Cells 9 912, 2020
-
Vaupel & Multhoff J Physiol 599:1745-1757, 2021
-
Schwab et al. Cancers 13:3762, 2021
-
Schwab et Multhoff Front Oncol 12:861266, 2022
-
Schwab et al. Rad Oncol 19:7, 2024
Mikrovaskuläre Endothelzellen aus Tumor- und Normalgeweben unterscheiden sich hinsichtlich ihrer Zelloberflächenmerkmale und Endothelzelleigenschaften. In diesem Projekt wird die Strahlenempfindlichkeit von mikrovaskulären Endothelzellen aus Tumor- und Normalgeweben vergleichend untersucht und es wurden Mechanismen aufgeklärt, die für eine Strahlen-induzierte Inflammation verantwortlich sind und es wurden Substanzen identifiziert und charakterisiert, welche in der Lage sind Normalgewebe vor Strahlenschäden in vitro und in Tiermodellen zu schützen.
Förderung
- BMBF - Kompetenzverbund Strahlenforschung
Schlüsselpublikationen
- Fan et al. IJROB 112:747-758, 2022
- Wang et al. CDD 9:286. 2023
- Alkotub et al. Redox Biology, accepted 2024
Seit wenigen Jahren sind Hochpräzisionsgeräte zur bildgestützten Bestrahlung von Tumoren in Kleintieren erhältlich. Mit diesen Geräten können bislang ungeklärte Fragen in der modernen Hochpräzisions-Strahlentherapie in klinisch relevanten Modellen untersucht werden. Mit der „Small Animal Radiation Research Platform“, die unserer Klinik zur Verfügung steht (DFG Großgerät Multhoff), konnten Langzeitschäden am Herzen nach Bestrahlung von Brustkrebs in Mäusen nachgestellt werden, pathophysiologische Mechanismen aufgeklärt werden und der Einfluss der Bestrahlung auf die Mikrozirkulation im Gehirn mittels MSOT Technologie untersucht werden.
Förderung
- DFG Großgeräteantrag SARRP
Shevtsov MA, Nikolaev BP, Ryzhov VA, Yakovleva LY, Marchenko YY, Parr MA, Rolich VI, Mikhrina AL, Dobrodumov AV, Pitkin E, Multhoff G. Ionizing radiation improves glioma-specific targeting of superparamagnetic iron oxide nanoparticles conjugated with cmHsp70.1 monoclonal antibody (SPION-cmHsp70.1) Nanoscale 7(48):20652-20664, 2015 (DOI 10.1039/C5NR06521F) (7.4)
Sievert W, Stangl S, Steiger K, Multhoff G. Improved overall survival of mice by reducing lung side effects after high-precision heart irradiation using a small animal radiation research platform (SARRP). Int J Radiat Oncol Biol Phys 101(3):671-679, 2018 (DOI 10.1016/jirobp.2018.02.017) (5)
Estrada H, Rebling J, Sievert W, Hladik D, Hofmann U, Gottschalk S, Tapio S, Multhoff G, Razansky D. Intravital optoacoustic and ultrasound biomicroscopy reveal radiation-inhibited skull angiogenesis. Bone 133:115251, 2020 (DOI 10.1016/jbone.2020.11525) (7)
Der Einsatz der tumorspezifischen Hsp70-Werzeuge (Antikörper, Fab Fragment, Peptid) kann das Imaging von kleinsten Tumoren und Metastasen mittels innovativer Methoden wie z.B. dem bispektralen Fluoreszenzimaging im Infrarotbereich (nIR), die multispektrale optoakustische Tomographie (MSOT), das PET und MRT-CT Imaging mittels superparamagnetischer Eisen oder Goldnanopartikel signifikant verbessern.
Schlüsselpublikationen
-
Shevtsov et al. Neuro Oncol 16:38, 2014
-
Shevtsov et al. Oncotarget 5:3101, 2014
-
Shevtsov et al. Int J Cancer 135:2118, 2014
-
Shevtsov et al. JMMM 388:123, 2015
-
Tzoumas et al. Nat Com 7:12121, 2016
-
Shevtsov et al. Int J Nanomed 13:1471, 2018
-
Klapproth et al. Int J Nanomed, 2020
-
Kimm et al. Cancers 12:1331, 2020
Stangl S, Gehrmann M, Riegger J, Kuhs K, Riederer I, Sievert W, Hube K, Mocikat R, Dressel R, Kremmer E, Pockley AG, Friedrich L, Vigh L, Skerra A, Multhoff G. Targeting membrane Hsp70 on tumors by cmHsp70.1 antibody. PNAS USA 108(2):733-738, 2011 (10)
Stangl S, Varga J, Freysoldt B, Trajkovic-Arsic M, Siveke JT, Greten FR, Ntziachristos V, Multhoff G. Selective in vivo imaging of syngeneic, spontaneous and xenograft tumors using a novel Tumor cell-specific Hsp70 peptide-based probe. Can Res 74(23):6903-6912, 2014 (DOI 10.1158/0008-5472 Can-14-0413) (9.3)
Tzoumas S, Nunes A, Olefir I, Stangl S, Symvoulidis P, Glasl S, Bayer C, Multhoff G, Ntziachristos V. Eigenspectra optoacoustic tomography achieves quantitative blood oxygenation imaging deep in tissues. Nature Communications 7:12121, 2016 (DOI 10.1038/ncomms12121) (11.47)
Stangl S, Tei L, De Rose F, Reder S, Martinelli J, Sievert W, Shevtsov M, Öllinger R, Rad R, Schwaiger M, D`Alessandria C, Multhoff G. Preclinical evaluation of the Hsp70 specific peptide tracer TPP-PEG24-DFO-[89Zr] for tumor-specific PET/CT imaging. Can Res 78(21):6268-6281, 2018 (DOI 10.1158/0008-5472.CAN-18-0707) 2018 (9.5)
Kimm MA, Shevtsov M, Werner C, Sievert W, Zhiyuan W, Schoppe O, Menze BH, Rummeny EJ, Proska R, Bystrova O, Martynova M, Multhoff G, Stangl S. Gold nanoparticle mediated multi-modal CT imaging of Hsp70 membrane-positive tumors. Cancers 12(5): 1331, doi: 10.3390/cancers12051331, 2020 (5.9)
Schwerpunkt Biomarker und Tumorimmunologie
Ein besseres Verständnis von Faktoren, welche die individuelle Strahlenempfindlichkeit beeinflussen, kann die Heilungschancen von Tumorerkrankungen verbessern. Im BMBF Verbundprojekt „Personalized and Targeted Therapies“ werden innovative Tumor-Biomarker (Hsp70, HMBG1, Annexin A5, Survivin) validiert, die das Ansprechen eines Tumors auf Strahlen- und Chemotherapie vorhersagen können. Darüber hinaus wird die Wertigkeit von zirkulierenden Tumorzellen als Tumorbiomarker überprüft.
Förderung
- BMBF Kompetenzverbund
Schlüsselpublikationen
-
Nylandsted et al. J Exp Med 200:425, 2004
-
Multhoff Methods 43:229, 2007
-
Gehrmann et al. PLosOne 3:e1925, 2008
-
Schmid Multhoff Cur Med Chem 19:1765, 2012
-
Breuninger et al. Front Oncol 8:497, 2018
Intra-, Membran-gebundenes und extrazellulär lokalisiertes Hsp70, PDL-1 und Lymphozyten Subpopulationen fungieren als Tumorbiomarker bei Plattenepithelkarzinom im Kopf-/Halsbereich (SCCHN).
Schlüsselpublikationen
-
Gehrmann et al. Rad Oncol 9:131, 2014
-
Balermpas et al. Int J Can 138:171, 2015
-
Balermpas et al. Int J Can 141:594, 2017
-
Stangl et al. Int J Can 142:1911, 2018
-
Fellinger et al. Cancers 9:912, 2020
-
Lobinger et al. Front Microbiol, 2021
Unser Labor konnte einen neuen ELISA etablieren (Patent), der in der Lage ist, Hsp70 im Blut (Serum/Plasma) von Tumorpatienten quantitativ zu erfassen. Tumorpatienten weisen signifikant höhere Hsp70 Werte im Blut auf als gesunde Spender. Exosomale Hsp70 Werte im Blut sind indikativ für die vitale Tumormasse wohingegen freies Hsp70 von toten Tumorzellen freigesetzt wird.
Schlüsselpublikationen
-
Breuninger et al. JCCI 5:4, 2015
-
Werner et al. Cancers 13:3706, 2021
-
Seier et al. Cancers 14:5701, 2022
-
Lennartz et al. Biomed 11:3235, 2023
-
Xanthopoulos et al. Biomed 11:2276, 2023
-
Safi et al. Biomol 13:874, 2023
NK-Zellen, die ex vivo mit dem Hsp70-Peptid TKD plus Interleukin 2 stimuliert wurden, weisen eine erhöhte Freisetzung von Granzym B auf und kontrollieren somit Hsp70-tragende Tumore in Mäusen. Zusammen mit dem positiven Ausgang einer klinischen Phase I Verträglichkeitsstudie wurde eine Phase II „Proof-of-concept“-Studie initiiert, um die Wertigkeit Hsp70-aktivierter NK-Zellen in Patienten mit fortgeschrittenen NSCLC zu überprüfen. Die Studie wurde vom BMBF mit 1.5 Mio. Euro gefördert. Die Ergebnisse der Phase II Studie zeigen ein verbessertes progressionsfreies und Gesamtüberleben in NSCLC Patienten, das von Hsp70-Peptid stimulierten NK Zellen vermittelt ist. Im Rahmen einer Pilotstudie konnte überdies gezeigt werden, dass eine Kombinationstherapie bestehend aus Radiochemotherapie, NK-Zelltherapie und dem Immuncheckpoint Inhibitor PD-1 sehr gut toleriert wird und anti-Tumor Immuneffekte induziert, die mit einer langanhaltenden Tumorkontrolle einhergehen. Die ermutigenden Daten der Kombinationstherapie rechtfertigen die Durchführung weiterführender randomisierter Studien.
Förderung
- BMBF – Innovative Therapien
- BMBF – NSCLC
- DKTK
Schlüsselpublikationen
-
Krause et al. Clin Can Res 10:3699, 2004
-
Pfister et al. Can 110:926, 2007
-
Milani et al. J Trans Med 7:50, 2009
-
Specht et al. Front Immunol 162:1-9, 2015
-
Gunther et al. Front Immunol 6:556, 2015
-
Kokowski et al. Strahlenther Onkol 195:352, 2019
-
Multhoff et al. Clin Cancer Res 26:5368-5379, 2020
Vicencio JM, Yellon DM, Sivaraman V, Das D, Boi-Doku C, Arjun S, Zheng Y, Riquelme JA, Kearney J, Sharma V, Multhoff G, Hall AR, Davidson SM. Plasma exosomes protect the myocardium from ischemia-reperfusion injury. J Am Coll Cardiol (JACC) 2015 Apr 21 65(15):1525-1536, 2015 (DOI 10.1007/s00262-015-1665-9) (15.3)
Specht HM, Ahrens N, Blankenstein C, Duell T, Fietkau R, Gaipl US, Günther C, Gunther S, Habl G, Hautmann H, Hautmann M, Huber RM, Molls M, Offner R, Rödel C, Rödel F, Schütz M, Combs SE, Multhoff G. Heat shock protein 70 (Hsp70) peptide activated NK cells for the treatment of patients with non-small cell lung carcinoma (NSCLC) after radiochemotherapy (RCTx) - from preclinical studies to a clinical phase II trial. Front Immunol. NK cell biology, Research Topic NK cell based immunotherapy. 2015 Apr 15 6:162: 1-9, 2015 (DOI 10.3389/fimmu.2015.00162) (4.0)
Gunther S, Ostheimer C, Stangl S, Specht HM, Mozes P, Jesinghaus M, Vordermark D, Combs SE, Peltz F, Jung MP, Multhoff G. Correlation of Hsp70 serum levels with gross tumor volume and composition of lymphocyte subpopulations in patients with squamous cell and adeno non-small cell lung cancer (NSCLC). Frontiers Immunol 6:556, 2015 (DOI 10.3389/fimmunol.2015.00556) (4)
Stangl S, Tontcheva N, Sievert W, Shevtsov M, Niu M, Schmid TE, Pigorsch S, Combs SE, Haller B, Balermpas P, Rödel F, Rödel C, Fokas E, Krause M, Linge A, Lohaus F, Baumann M, Tinhofer I, Budach V, Stuschke M, Grosu AL, Abdollahi A, Debus J, Belka C, Maihöfer C, Mönnich D, Zips D, Multhoff G. Heat shock protein 70 expression and tumor-infiltrating NK cells as prognostic indicators for patients with squamous cell carcinoma of the head and neck (SCCHN) after radiochemotherapy: a multicentre retrospective study of the German Cancer Consortium Radiation Oncology (DKTK-ROG) Int J Can 142(9):1911-1925, 2018 (DOI 10.1002/ijc.31213) (4)
Ostheimer C, Gunther S, Bache M, Vordermark D, Multhoff G. Dynamics of heat shock protein 70 (Hsp70) serum levels as a predictor of clinical response in non-small cell lung cancer (NSCLC) and correlation with the hypoxia-related marker osteopontin. Frontiers Immunol Inflammation Stress & Immunity 8:e1305, 2017 (DOI 10.3389/fimmu.2017.01305) (6.5)
Kokowski K, Stangl S, Seier S, Hildebrandt M, Vaupel P, Multhoff G. Radiochemotherapy combined with NK cell transfer folloed by second-line PD-1 inhibition in a patient with NSCLC stage IIIb inducing long-term tumor control: a case study. Starhlenther Onkol 195:352, 2019
Shevtsov M, Pitkin E, Ischenko A, Stangl S, Khachatryan W, Galibin O, Edmond S, Lobinger D, Multhoff G. Ex vivo Hsp70 activated NK cells in combination with PD-1 inhibition significantly increase overall survival in preclinical models of glioblastoma and lung cancer. Front Immunol 10:e454, 2019 (7)
Multhoff G, Seier S, Stangl S, Sievert W, Shevtsov M, Werner C, Pockley AG, Blankenstein C, Hildebrandt M, Offner R, Ahrens N, Kokowski K, Hautmann M, Rödel C, Fietkau R, Lubgan D, Huber R, Hautmann H, Duell T, Molls M, Specht H, Haller B, Devecka M, Sauter A, Combs SE. Targeted Natural Killer Cell-Based Adoptive Immunotherapy for the Treatment of Patients with NSCLC after Radiochemotherapy: A Randomized Phase II Clinical Trial. Clin Cancer Res, doi: 10.1158/1078-0432.CCR-20-1141, 2020 (10.1)