
Strahlentherapie
AG Tumorimaging & Immunologie
Unsere Arbeitsgruppe widmet sich drei zentralen Forschungsschwerpunkten: Tumorimaging, Radioonkologie sowie Biomarkern und Tumorimmunologie.

Eine effektive Visualisierung von Tumoren ist die Grundlage für eine frühzeitige Diagnose ebenso wie für ein effektives Therapie-Monitoring. Um die Sensitivität und Präzision der dafür notwendigen Bildgebung zu erhöhen, werden verstärkt Techniken eingesetzt, die auf der selektiven Markierung von Tumorzellen im Primärtumor und aller vorhandenen Metastasen basieren. Besonders bei der gezielten Bekämpfung der Läsionen mittels chirurgischer Sektion oder Radiotherapie ist eine Erfassung aller vorhandenen Tumore unablässig.
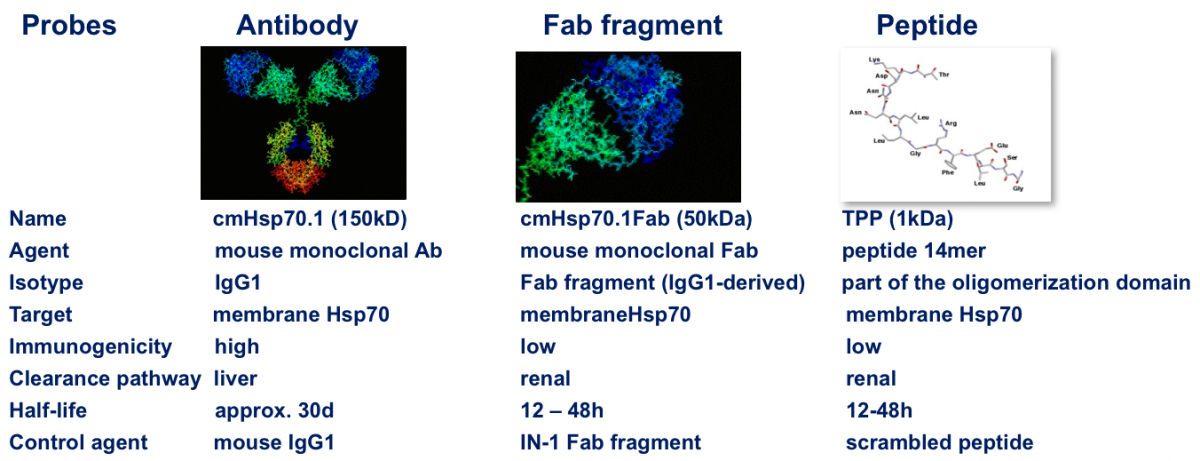
Unser Labor entwickelt und untersucht hierfür selektive Tumorwerkzeuge (Antikörper, Fab Fragment, Peptide), die nach intravenöser Gabe oder topischer Applikation alle Tumorherde im Körper selbständig detektieren. Grundlage dafür ist die besondere Eigenschaft von Tumoren fast aller Entitäten, den Tumorbiomarker Hitzeschockprotein 70 (Hsp70), ein Protein der Klasse der molekularen Chaperone, auf der Oberfläche von maligne entarteten Zellen zu präsentieren. Dieser tumor-spezifische Biomarker kann je nach Anforderung mit Signalmolekülen oder Zell-Therapeutika wie z.B. CAR T/NK-Zellen ausgestattet werden, um den Tumor sichtbar zu machen und/oder auch direkt zu bekämpfen (Theranostik). Ein neuartiger ELISA (Hsp70 exo ELISA) ist in der Lage Hsp70, das von Membran Hsp70 positiven Tumoren stammt im Blut zu detektieren und kann somit als companion Diagnostic zur Patientenrekrutierung eingesetzt werden.
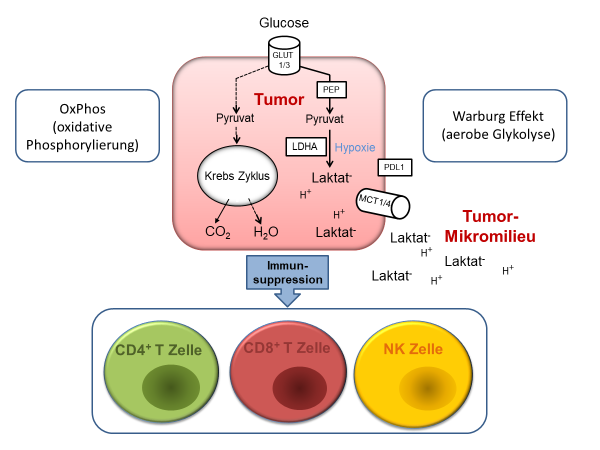
Aufgrund der gesteigerten Proliferationsraten in Tumorzellen kommt es zu einer metabolischen Umprogrammierung zugunsten der aeroben Glycolyse (Warburg Effekt). Der Warburg-Effekt erlaubt eine rasche ATP Produktion, die mit einem Anstieg von Oncometaboliten wie z. B. Laktat in Tumormikromilieu assoziiert ist. Hohe Laktat-Gehalte erlauben Tumor-Immun-Escape-Mechanismen und fördern Immunsuppression. Eine chaotische Gefäßversorgung im Tumor führt zur Hypoxie.
Mikrovaskuläre Endothelzellen aus Tumor- und Normalgeweben unterscheiden sich hinsichtlich ihrer Zelloberflächenmerkmale und Endothelzelleigenschaften. In diesem Projekt wird die Strahlenempfindlichkeit von mikrovaskulären Endothelzellen aus Tumor- und Normalgeweben vergleichend untersucht und es wurden Mechanismen aufgeklärt, die für eine Strahlen-induzierte Inflammation verantwortlich sind und es wurden Substanzen identifiziert und charakterisiert, welche in der Lage sind Normalgewebe vor Strahlenschäden in vitro und in Tiermodellen zu schützen.
Seit wenigen Jahren sind Hochpräzisionsgeräte zur bildgestützten Bestrahlung von Tumoren in Kleintieren erhältlich. Mit diesen Geräten können bislang ungeklärte Fragen in der modernen Hochpräzisions-Strahlentherapie in klinisch relevanten Modellen untersucht werden. Mit der „Small Animal Radiation Research Platform“, die unserer Klinik zur Verfügung steht (DFG Großgerät Multhoff), konnten Langzeitschäden am Herzen nach Bestrahlung von Brustkrebs in Mäusen nachgestellt werden, pathophysiologische Mechanismen aufgeklärt werden und der Einfluss der Bestrahlung auf die Mikrozirkulation im Gehirn mittels MSOT Technologie untersucht werden.
Der Einsatz der tumorspezifischen Hsp70-Werzeuge (Antikörper, Fab Fragment, Peptid) kann das Imaging von kleinsten Tumoren und Metastasen mittels innovativer Methoden wie z.B. dem bispektralen Fluoreszenzimaging im Infrarotbereich (nIR), die multispektrale optoakustische Tomographie (MSOT), das PET und MRT-CT Imaging mittels superparamagnetischer Eisen oder Goldnanopartikel signifikant verbessern.
Ein besseres Verständnis von Faktoren, welche die individuelle Strahlenempfindlichkeit beeinflussen, kann die Heilungschancen von Tumorerkrankungen verbessern. Im BMBF Verbundprojekt „Personalized and Targeted Therapies“ werden innovative Tumor-Biomarker (Hsp70, HMBG1, Annexin A5, Survivin) validiert, die das Ansprechen eines Tumors auf Strahlen- und Chemotherapie vorhersagen können. Darüber hinaus wird die Wertigkeit von zirkulierenden Tumorzellen als Tumorbiomarker überprüft.
Intra-, Membran-gebundenes und extrazellulär lokalisiertes Hsp70, PDL-1 und Lymphozyten Subpopulationen fungieren als Tumorbiomarker bei Plattenepithelkarzinom im Kopf-/Halsbereich (SCCHN).
Unser Labor konnte einen neuen ELISA etablieren (Patent), der in der Lage ist, Hsp70 im Blut (Serum/Plasma) von Tumorpatienten quantitativ zu erfassen. Tumorpatienten weisen signifikant höhere Hsp70 Werte im Blut auf als gesunde Spender. Exosomale Hsp70 Werte im Blut sind indikativ für die vitale Tumormasse wohingegen freies Hsp70 von toten Tumorzellen freigesetzt wird.
NK-Zellen, die ex vivo mit dem Hsp70-Peptid TKD plus Interleukin 2 stimuliert wurden, weisen eine erhöhte Freisetzung von Granzym B auf und kontrollieren somit Hsp70-tragende Tumore in Mäusen. Zusammen mit dem positiven Ausgang einer klinischen Phase I Verträglichkeitsstudie wurde eine Phase II „Proof-of-concept“-Studie initiiert, um die Wertigkeit Hsp70-aktivierter NK-Zellen in Patienten mit fortgeschrittenen NSCLC zu überprüfen. Die Studie wurde vom BMBF mit 1.5 Mio. Euro gefördert. Die Ergebnisse der Phase II Studie zeigen ein verbessertes progressionsfreies und Gesamtüberleben in NSCLC Patienten, das von Hsp70-Peptid stimulierten NK Zellen vermittelt ist. Im Rahmen einer Pilotstudie konnte überdies gezeigt werden, dass eine Kombinationstherapie bestehend aus Radiochemotherapie, NK-Zelltherapie und dem Immuncheckpoint Inhibitor PD-1 sehr gut toleriert wird und anti-Tumor Immuneffekte induziert, die mit einer langanhaltenden Tumorkontrolle einhergehen. Die ermutigenden Daten der Kombinationstherapie rechtfertigen die Durchführung weiterführender randomisierter Studien.